L'EMDR animal-recherche scientifique
Validation du modèle animal de l'EMDR par l'INSERM
Le modèle animal de l'état de stress post-traumatique et mise au point d'un protocole de stimulation EMDR chez le rongeur.
Cyril Herry
Wurtz H, El-Khoury-Malhame M, Wilhelm F, Michael T, Beetz EM, Roques J, Reynaud E, Courtin J, Khalfa S, Herry C. Preventing long-lasting fear recovery using bilateral alternating sensory stimulation: a translational study. Neuroscience 2016; 321: 222-235.
L’état de stress post-traumatique (ESPT) semble majoritairement reposer sur une altération des mécanismes de traitement de la peur. Une façon de modéliser cette pathologie consiste donc à utiliser le modèle de conditionnement et d’extinction de la peur, dans lequel il y a comme dans l’ESPT un apprentissage de la peur. Cette peur peut plus ou moins perdurer même en l’absence de danger. Ainsi dans ce modèle, les animaux ou les hommes vont apprendre qu'un stimulus initialement neutre (le stimulus conditionnel ou SC) comme un son ou une image est associé de manière répétitive à un stimulus aversif comme un choc électrique par exemple (le stimulus inconditionnel). C’est ce qu’on appelle l’acquisition, le conditionnement ou la mémorisation de la peur. Cependant, si le stimulus neutre est ensuite présenté plusieurs fois sans le stimulus aversif, il y a généralement extinction de la peur, le sentiment de danger disparait. Dans l’ESPT, l’évènement traumatisant reste toujours présent en mémoire et tout se passe comme si la mémorisation de la peur ne pouvait s’éteindre. Afin d’étudier ce mécanisme, des études ont été entreprises chez l’animal et chez l’homme en utilisant ce modèle de conditionnement/extinction de la peur. Les corrélats cérébraux de ce modèle semblent très similaires de l’animal à l’homme. Les recherches ont permis d’identifier des structures et mécanismes cérébraux impliqués, ce qui devrait favoriser des évolutions thérapeutiques du traitement de l’ESPT.
Chez l'animal de nombreux travaux ont proposé des modèles animaux de l'EPST basés sur la reproduction de symptômes spécifiques comme la généralisation des réponses de peur à des stimuli ou bien des lieux non associés au traumatisme original, la résistance à l'extinction des réponses conditionnées de peur, l'hypervigilance et l'évitement des stimuli associés au trauma1-3. Cependant, il n'existe à l'heure actuelle que peu de modèles animaux reproduisant la rechute à long-terme des mémoires traumatiques de peur observée dan l'EPST malgré la mise en place de traitements efficaces1,4. Des travaux récents indiquent que suite à l'extinction de la peur conditionnée chez le rongeur, la réexposition au contexte d'extinction, au contexte de conditionnement ou bien au stimulus inconditionnel (généralement un choc électrique léger) peut précipiter la rechute des réponses conditionnées de peur1,5,6. Cependant, il reste à vérifier si ce phénomène de rechute se produit chez l'ensemble des individus testés. Cette variabilité interindividuelle est de nos jours considérée comme une composante critique des modèles animaux de l'EPST car elle permet l'identification de facteurs prédictifs de résilience ou de susceptibilité à la traumatisation2,7,8. Dans ce contexte et afin d'évaluer cette variabilité interindividuelle, nous avons récemment établi un modèle animal de l'EPST basé sur la rechute à long-terme des réponses conditionnées de peur à la suite du conditionnement et de l'extinction de la peur conditionnée. Suite à l'extinction de la peur conditionnée, nous avons observée une distribution hétérogène des réponses des peurs conditionnées lors de la réexposition des animaux au stimulus conditionnel, avec la moitié des animaux qui présentaient de forts niveaux de peurs (animaux vulnérables) et l'autre moitié un maintien de l'extinction de la peur conditionnée avec des niveaux de peur faibles (animaux résistants) (Figure 1).
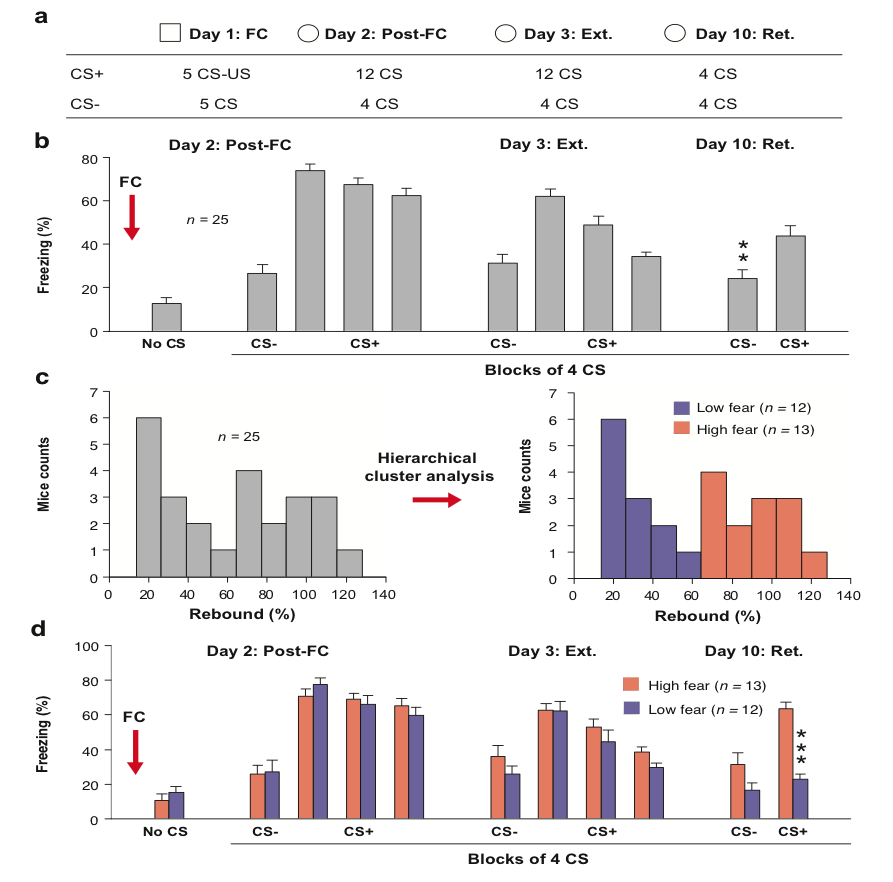
Figure 1: Vulnérabilité interindividuelle à la rechute des réponses conditionnées de peur. a. Protocole comportemental b. Comportement de freezing moyen observé chez le rongeur (n = 25 souris) avant (no CS) et en réponse au stimulus control (CS-) et conditionnel (CS+) au cours des deux jours d'extinction de la peur conditionnée (Day 2/3) à la suite du conditionnement (FC) et une semaine à la suite de l'extinction pour une session de rappel (Day 10: Ret.). c. Gauche, Distribution des valeurs pour le rebond de freezing (calculé comme les valeurs de freezing lors de la présentation du CS+ lors du rappel divisé par les valeurs de freezing au cours du premier blocs de CS+ à la suite du conditionnement (Post-FC)). Droite, une analyse en cluster hiérarchique nous a permis de mettre en évidence deux groupes de souris présentant des niveaux de rebond de freezing élevés (High fear mice, n = 13) ou bas (Low fear mice, n = 12). d. Pourcentage de freezing chez les souris High fear ou Low fear avant (no CS) au stimulus control (CS-) et conditionnel (CS+) au cours des deux jours d'extinction de la peur conditionnée (Day 2/3) à la suite du conditionnement (FC) et une semaine à la suite de l'extinction pour une session de rappel (Day 10: Ret.). ** P < 0.01; *** P < 0.001. Figure issue de Wurtz et al, 2015.
De façon importante, nous avons observé que le niveau de peur des animaux vulnérables et résistants au cours de l'extinction n’était pas différent ce qui suggère des processus d'encodage similaire pour l'extinction de la peur conditionnée chez les deux groupes d'animaux. Au cours des dernières décennies, les études réalisées chez l'homme et le rongeur ont notamment permis d'établir un modèle de référence des circuits neuronaux impliqués dans la régulation des réponses émotionnelles de peur (Figure 2). Ce modèle indique que l’amygdale, une structure du lobe temporal médian, joue un rôle clé dans l’apprentissage du conditionnement de peur (Ledoux, 2000). Au contraire, le cortex préfrontal médian (CPFm) semble jouer un rôle différentiel dans la régulation des réponses de peur conditionnée avec un rôle clef du CPFm ventral dans les processus d'extinction et de consolidation de l'extinction alors que le CPFm dorsal a plus largement été impliquée dans l'expression des réponses de peur 9,10.
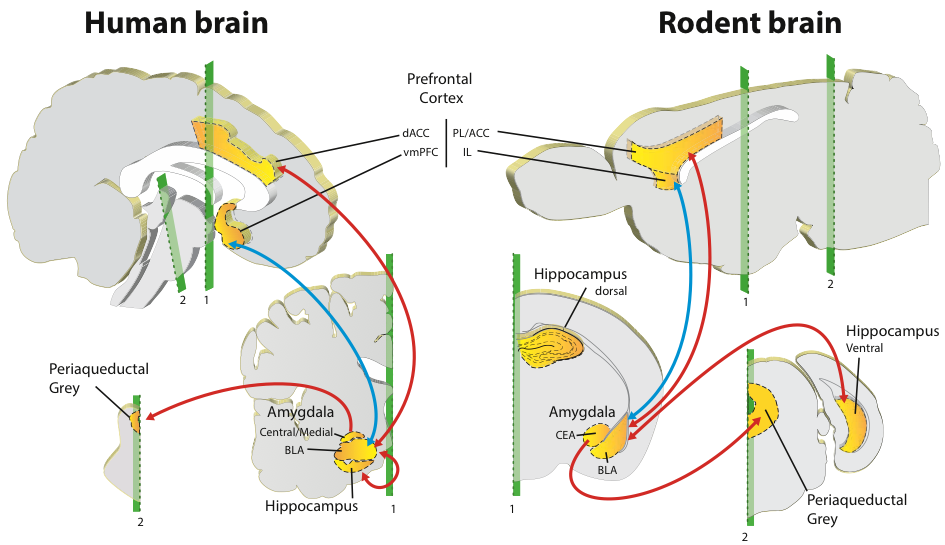
Figure 2: Structures neuronales homologues chez l'homme et le rongeur impliquées dans l'expression et l'inhibition des réponses conditionnées de peur. Les structures neuronales classiquement impliquées dans l'expression et l'inhibition de la peur chez l'homme et le rongeur sont l'amygdale basolatérale (BLA) ainsi que l'amygdale centrale (amygdale centrale/médiane chez l'homme et CEA chez le rongeur) localisées dans le lobe temporal médian, le cortex préfrontal (composé des régions dorsales (cortex cingulaire antérieur dorsal chez l'homme (CCAd) et aire prélimbique (PL) et cortex cingulaire antérieur (ACC) chez le rongeur), et des régions ventrales (cortex préfrontal médian ventral chez l'homme (CPFvm), aire infralimbique (IL) chez le rongeur)). Ces structures projettent sur la substance grise périaqueductale localisée dans le tronc cérébral. Au cours de l'expression de la peur (lignes rouges), les informations contextuelles sont relayées de l'hippocampe à l'amygdale. Les relations bidirectionnelles entre le BLA et le cortex préfrontal médian dorsal permet la mise à jour des informations émotionnelles de peur, qui sont transmises vers l'amygdale centrale et de là vers la substance grise périaqueductale. L'inhibition de la peur au cours de l'extinction dépend de la connectivité bidirectionnelle entre le cortex préfrontal médian ventral et le BLA (lignes bleues) qui régulent l'activité de l'amygdale centrale afin de réduire les réponses conditionnées de peur. Figure issue de Dejean et al., 2015.
En particulier, des lésions ou inactivations du PL sont associées avec une réduction des réponses de peur conditionnées11-15. Au contraire, les mêmes manipulations de l'IL induisent une augmentation de ces mêmes réponses16-18. Des stimulations électriques du PL et de l'IL ont permis de confirmer ces données puisque la micro-stimulation de ces régions augmente et diminue les réponses conditionnées de peur, respectivement19,20. Des données électrophysiologiques ont également pu mettre en évidence que l'activité des neurones du PL et IL est corrélée avec l'expression et l'inhibition des réponses de peur, respectivement19-25. Enfin, le blocage de la consolidation de l'extinction par l'utilisation d'antagonistes de récepteur NMDA ou bien des injections d'anisomycine ou encore le blocage des récepteurs noradrénergiques ou dopaminergiques précipite le retour de la peur conditionnée21,26-31.
Sur la base de ces données, l'interprétation la plus simple des résultats concernant notre modèle comportemental de l'EPST est que les animaux présentant de faibles réponses de peur présentent une consolidation de la mémoire de l'extinction, tandis que les animaux avec de fortes réponses de peur lors du test de rappel présenteraient un déficit de consolidation de l'extinction. De façon importante, bien que certaines études ont observé une variabilité des réponses conditionnées de peur lors du test de rappel à la suite de l'extinction de la peur conditionnée21,32, notre modèle comportemental capture une caractéristique importante des troubles anxieux et de l'ESPT, c'est à dire l'existence d'une distribution hétérogène des réponses émotionnelles de peur à la suite d'un traitement efficace33-36 ou bien à la suite d'une procédure d'extinction de la peur conditionnée37. Le phénomène de variabilité interindividuelle est considéré comme un facteur clef de plusieurs pathologies psychiatriques comme l'addiction38,39 et l'ESPT2,7,8 car il permet d'identifier des facteurs prédictifs de résilience ou de susceptibilité à certaines pathologies. Ainsi notre modèle comportemental de variabilité interindividuelle des réponses de peur conditionnées à la suite de l'extinction présente une très bonne validité prédictive.
Afin de tester la validité apparente de notre modèle comportemental de l'EPST, nous avons développé chez le rongeur une procédure proche des thérapies EMDR très efficaces chez le sujet humain dans le traitement des pathologies de type ESPT. Cette procédure est basée sur une stimulation électrique indolore bilatérale alternée de la paupière chez le rongeur au cours du conditionnement de peur et de l'extinction de la peur conditionnée. Notre objectif était de tester si ce protocole de stimulation permettait de réduire de façon significative la rechute des réponses conditionnées de peur à la suite de l'extinction. Nos travaux indiquent que la stimulation bilatérale alternée appliquée au cours de la phase d'extinction de la peur conditionnée était associée à un maintien de faibles réponses de peur lors du test de rappel pour l'ensemble des animaux testés en comparaison à la situation contrôle (Figure 3). Ces données indiquent un effet bénéfique de la stimulation bilatérale alternée lorsque cette dernière est administrée au cours de la procédure d'extinction (présentation du CS seul) et suggèrent qu'une telle procédure pourrait être appliquée chez l'animal souffrant d'ESPT. Finalement, ces données confirment également la validité apparente de notre modèle comportementale de l'ESPT, puisque l'application d'une procédure analogue aux thérapies EMDR chez l'animal est associée à une réduction du phénomène de rechute des réponses conditionnées de peur chez le rongeur.
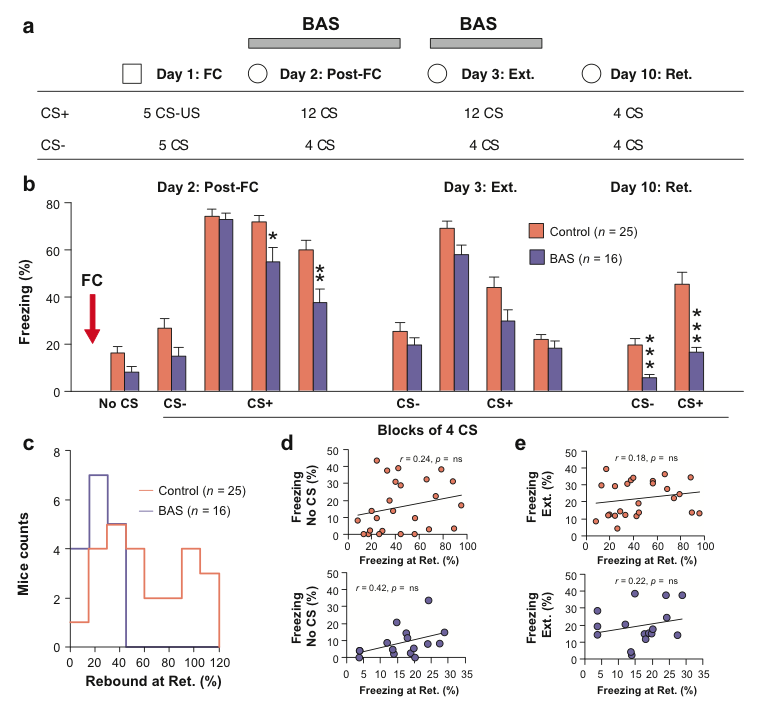
Figure 3: Stimulation bilatérale alternée au cours du comportement de peur. a. Protocole comportemental b. Comportement de freezing moyen observé chez le rongeur avant (no CS) et en réponse au stimulus control (CS-) et conditionnel (CS+) au cours des deux jours d'extinction de la peur conditionnée (Day 2/3) à la suite du conditionnement (FC) et une semaine à la suite de l'extinction pour une session de rappel (Day 10: Ret.) poiur les animaux contrôles (Control, n = 25) et les animaux stimulés (BAS, n = 16). La simulation bilatérale alternée de la paupière a été réalisée lors de la phase d'extinction. c. Distribution des valeurs pour le rebond de freezing (calculé comme les valeurs de freezing lors de la présentation du CS+ lors du rappel divisé par les valeurs de freezing au cours du premier blocs de CS+ à la suite du conditionnement (Post-FC)) pour les animaux contrôles et les animaux stimulés. d. Corrélation entre les niveaux de freezing observés avant présentation du son (No CS) et lors du test de rappel pour les animaux contrôles (haut) et les animaux stimulés (bas). e. Corrélation entre les niveaux de freezing observés lors de l'extinction et lors du test de rappel pour les animaux contrôles (haut) et les animaux stimulés (bas). * P < 0.05; ** P < 0.01; *** P < 0.001. Figure issue de Wurtz et al, 2015.
Le modèle du conditionnement/extinction de la peur apparait constituer un modèle valable et utile tant pour l’étude de l’ESPT que de son traitement. En effet, les corrélats neuronaux de l’ESPT lors du rappel de l’évènement traumatique sont également ceux que l’on retrouve en utilisant le modèle de conditionnement/extinction de la peur. De plus, nos données décrivent pour la première fois un modèle animal de l'EMDR qui permet de réduire de façon significative le phénomène de rechute des réponses conditionnées de peur.
Références :
- Goode, T.D. & Maren, S. Animal models of fear relapse. ILAR J 55, 246-258 (2014).
- Goswami, S., Rodriguez-Sierra, O., Cascardi, M. & Pare, D. Animal models of post-traumatic stress disorder: face validity. Front Neurosci 7, 89 (2013).
- Siegmund, A. & Wotjak, C.T. Toward an animal model of posttraumatic stress disorder. Ann N Y Acad Sci 1071, 324-334 (2006).
- Deschaux, O., Motanis, H., Spennato, G., Moreau, J.L. & Garcia, R. Re-emergence of extinguished auditory-cued conditioned fear following a sub-conditioning procedure: effects of hippocampal and prefrontal tetanic stimulations. Neurobiol Learn Mem 95, 510-518 (2011).
- Herry, C., et al. Neuronal circuits of fear extinction. The European journal of neuroscience 31, 599-612 (2010).
- Myers, K.M. & Davis, M. Mechanisms of fear extinction. Mol Psychiatry 12, 120-150 (2007).
- Cohen, H., Kozlovsky, N., Alona, C., Matar, M.A. & Joseph, Z. Animal model for PTSD: from clinical concept to translational research. Neuropharmacology 62, 715-724 (2012).
- Daskalakis, N.P. & Yehuda, R. Principles for developing animal models of military PTSD. Eur J Psychotraumatol 5(2014).
- Courtin, J., Bienvenu, T.C., Einarsson, E.O. & Herry, C. Medial prefrontal cortex neuronal circuits in fear behavior. Neuroscience 240, 219-242 (2013).
- Sotres-Bayon, F. & Quirk, G.J. Prefrontal control of fear: more than just extinction. Current opinion in neurobiology 20, 231-235 (2010).
- Akirav, I., Raizel, H. & Maroun, M. Enhancement of conditioned fear extinction by infusion of the GABA(A) agonist muscimol into the rat prefrontal cortex and amygdala. The European journal of neuroscience 23, 758-764 (2006).
- Blum, S., Runyan, J.D. & Dash, P.K. Inhibition of prefrontal protein synthesis following recall does not disrupt memory for trace fear conditioning. BMC Neurosci 7, 67 (2006).
- Corcoran, K.A. & Quirk, G.J. Activity in prelimbic cortex is necessary for the expression of learned, but not innate, fears. The Journal of neuroscience : the official journal of the Society for Neuroscience 27, 840-844 (2007).
- Joel, D., Tarrasch, R., Feldon, J. & Weiner, I. Effects of electrolytic lesions of the medial prefrontal cortex or its subfields on 4-arm baited, 8-arm radial maze, two-way active avoidance and conditioned fear tasks in the rat. Brain Res 765, 37-50 (1997).
- Sierra-Mercado, D., Jr., Corcoran, K.A., Lebron-Milad, K. & Quirk, G.J. Inactivation of the ventromedial prefrontal cortex reduces expression of conditioned fear and impairs subsequent recall of extinction. The European journal of neuroscience 24, 1751-1758 (2006).
- Lebron, K., Milad, M.R. & Quirk, G.J. Delayed recall of fear extinction in rats with lesions of ventral medial prefrontal cortex. Learning & memory 11, 544-548 (2004).
- Quirk, G.J., Russo, G.K., Barron, J.L. & Lebron, K. The role of ventromedial prefrontal cortex in the recovery of extinguished fear. The Journal of neuroscience : the official journal of the Society for Neuroscience 20, 6225-6231 (2000).
- Tian, S., et al. Ventrolateral prefrontal cortex is required for fear extinction in a modified delay conditioning paradigm in rats. Neuroscience 189, 258-268 (2011).
- Burgos-Robles, A., Vidal-Gonzalez, I. & Quirk, G.J. Sustained conditioned responses in prelimbic prefrontal neurons are correlated with fear expression and extinction failure. The Journal of neuroscience : the official journal of the Society for Neuroscience 29, 8474-8482 (2009).
- Vidal-Gonzalez, I., Vidal-Gonzalez, B., Rauch, S.L. & Quirk, G.J. Microstimulation reveals opposing influences of prelimbic and infralimbic cortex on the expression of conditioned fear. Learning & memory 13, 728-733 (2006).
- Burgos-Robles, A., Vidal-Gonzalez, I., Santini, E. & Quirk, G.J. Consolidation of fear extinction requires NMDA receptor-dependent bursting in the ventromedial prefrontal cortex. Neuron 53, 871-880 (2007).
- Courtin, J., et al. Prefrontal parvalbumin interneurons shape neuronal activity to drive fear expression. Nature 505, 92-96 (2014).
- Herry, C. & Garcia, R. Prefrontal cortex long-term potentiation, but not long-term depression, is associated with the maintenance of extinction of learned fear in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience 22, 577-583 (2002).
- Milad, M.R. & Quirk, G.J. Neurons in medial prefrontal cortex signal memory for fear extinction. Nature 420, 70-74 (2002).
- Milad, M.R., Vidal-Gonzalez, I. & Quirk, G.J. Electrical stimulation of medial prefrontal cortex reduces conditioned fear in a temporally specific manner. Behav Neurosci 118, 389-394 (2004).
- Hikind, N. & Maroun, M. Microinfusion of the D1 receptor antagonist, SCH23390 into the IL but not the BLA impairs consolidation of extinction of auditory fear conditioning. Neurobiol Learn Mem 90, 217-222 (2008).
- Mueller, D., Olivera-Figueroa, L.A., Pine, D.S. & Quirk, G.J. The effects of yohimbine and amphetamine on fear expression and extinction in rats. Psychopharmacology (Berl) 204, 599-606 (2009).
- Mueller, D., Porter, J.T. & Quirk, G.J. Noradrenergic signaling in infralimbic cortex increases cell excitability and strengthens memory for fear extinction. The Journal of neuroscience : the official journal of the Society for Neuroscience 28, 369-375 (2008).
- Pfeiffer, U.J. & Fendt, M. Prefrontal dopamine D4 receptors are involved in encoding fear extinction. Neuroreport 17, 847-850 (2006).
- Santini, E., Ge, H., Ren, K., Pena de Ortiz, S. & Quirk, G.J. Consolidation of fear extinction requires protein synthesis in the medial prefrontal cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience 24, 5704-5710 (2004).
- Sotres-Bayon, F., Diaz-Mataix, L., Bush, D.E. & LeDoux, J.E. Dissociable roles for the ventromedial prefrontal cortex and amygdala in fear extinction: NR2B contribution. Cerebral cortex 19, 474-482 (2009).
- Milad, M.R., et al. Recall of fear extinction in humans activates the ventromedial prefrontal cortex and hippocampus in concert. Biological psychiatry 62, 446-454 (2007).
- Boschen, M.J., Neumann, D.L. & Waters, A.M. Relapse of successfully treated anxiety and fear: theoretical issues and recommendations for clinical practice. Aust N Z J Psychiatry 43, 89-100 (2009).
- Rachman, S. The return of fear. Behaviour research and therapy 17, 164-166 (1979).
- Rodriguez, B.I., Craske, M.G., Mineka, S. & Hladek, D. Context-specificity of relapse: effects of therapist and environmental context on return of fear. Behaviour research and therapy 37, 845-862 (1999).
- Vervliet, B., Baeyens, F., Van den Bergh, O. & Hermans, D. Extinction, generalization, and return of fear: a critical review of renewal research in humans. Biol Psychol 92, 51-58 (2013).
- Milad, M.R., et al. Neurobiological basis of failure to recall extinction memory in posttraumatic stress disorder. Biological psychiatry 66, 1075-1082 (2009).
- Deroche-Gamonet, V., Belin, D. & Piazza, P.V. Evidence for addiction-like behavior in the rat. Science 305, 1014-1017 (2004).
- Piazza, P.V., Deminiere, J.M., Le Moal, M. & Simon, H. Factors that predict individual vulnerability to amphetamine self-administration. Science 245, 1511-1513 (1989).
